![[TOP] TÀI KHOẢN](https://hoachatthuonghieu.com/shop/images/hoachatthuonghieu/1.png)
| Luôn có khuyến mãi |
| Giao hàng toàn quốc |
| Bảo hành tận nơi |
| Đổi trả hàng trong 7 ngày |
Hotline: 0865537082
AXIT CLOHYDRIC HCL LÀ GÌ? CÁC PHƯƠNG PHÁP ĐIỀU CHẾ VÀ SẢN XUẤT AXIT CLOHYDRIC
Tin tức 16/03/2021
AXIT CLOHYDRIC HCL LÀ GÌ? CÁC PHƯƠNG PHÁP ĐIỀU CHẾ VÀ SẢN XUẤT AXIT CLOHYDRIC
Trong cuộc sống hàng ngày, đặc biệt là các ngành công nghiệp sản xuất sắt thép, xử lý nước, sản xuất thực phẩm, các hợp chất hữu cơ, vô cơ,…axit clohydric HCl được sử dụng rất phổ biến với vai trò là nguyên liệu hoặc chất xúc tác. Để tìm hiểu cụ thể hơn về Axit Clohydric HCl là gì? tính chất, cách điều chế và các ứng dụng của HCl trong đời sống hiện nay như thế nào, các bạn hãy cùng chúng tôi theo dõi nội dung bài viết dưới đây nhé.
Axit Clohydric HCl là gì?
Axit Clohidric (viết tắt là HCl) là một hợp chất vô cơ có tính axit mạnh, tồn tại ở 2 dạng đó là lỏng (tạo ra từ sự hòa tan khí hydro clorua trong nước) và khí.
Một số tên gọi khác: Axit clohydric, Axit hidrocloric, Axit muriatic, Cloran.
Trong ngành công nghiệp dược phẩm, hóa học, xây dựng các chế phẩm,…axit clohydric được sử dụng rộng rãi. Tuy nhiên, cần thận trong khi sử dụng vì nó có khả năng ăn mòn các mô con người, gây tổn thương cơ quan hô hấp, mắt, da và ruột.
Các tính chất đặc trưng của axit clohydric
1/ Tính chất vật lý của HCl
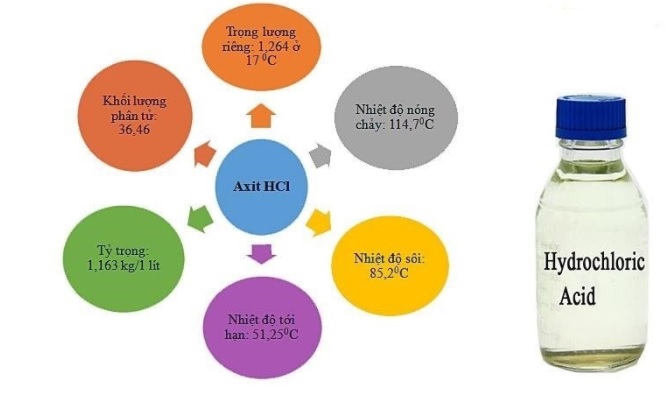
- Khi ở dạng khí, HCl không màu, có mùi xốc, nặng hơn không khí và tan nhiều trong nước tạo dung dịch axit mạnh.
- Khi ở dạng lỏng, HCl loãng không màu. Ở dạng đậm đặc 40%, axit HCl có màu vàng ngả xanh lá và có thể tạo thành sương mù axit, có khả năng ăn mòn và làm tổn thương các mô của con người.
- Độ hòa tan trong nước: 725g/l ở 20 độ C.
- Trọng lượng phân tử: 36,5 g/mol.
- Dung dịch HCl dễ bay hơi.
2/ Tính chất hóa học của axit clohydric – Những chất tác dụng với HCl
Axit HCl làm đổi màu chất chỉ thị, cụ thể là làm quỳ tím chuyển đỏ (dấu hiệu nhận biết HCl)
- HCl tác dụng với kim loại đứng trước H trong dãy hoạt động hóa học ( trừ Pb) tạo thành muối và khí Hydro
Fe + 2HCl → FeCl2 + H2↑
2Al + 6HCl → 2AlCl3 + 3H2↑
- HCl có tính oxy hóa: Tác dụng oxit kim loại tạo thành muối clorua + nước (kim loại không thay đổi hóa trị)
CuO + 2HCl → CuCl2 + H2O
- Tác dụng bazơ tạo thành muối clorua + nước
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
- HCl tác dụng với muối có gốc anion hoạt động yếu hơn tạo thành muối mới và axit mới, sản phẩm được tạo thành có thể kết tủa, khí bay lên hoặc là một axit mới yếu hơn
AgNO3 + HCl → AgCl + HNO3
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
- HCl có tính khử khi tác dụng với chất có tính oxy hóa mạnh như KMnO4, K2Cr2O7, MnO2, KClO3, …axit clohydric có tính khử.
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
2HCl + MnO2 → MnCl2 + Cl2↑ + H2O
14HCl + K2Cr2O7 → 2KCl + 2CrCl3 + 3Cl2↑ + 7H2O
16HCl + 2KMnO4 → 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
3/ HCl không tác dụng với chất nào
- Kim loại đứng sau H trong dãy điện hóa như Cu, Ag, Au,….
- Muối không tan có gốc CO3 và PO4, trừ K2CO3 và Na2CO3,K3PO4 và Na3PO4.
- HCl không tác dụng với tất cả các axit, phi kim, oxit kim loại, oxit phi kim.
Các phương pháp điều chế và sản xuất axit clohydric
1/ Trong phòng thí nghiệm
-Axit clohydric được điều chế bằng phương pháp sunfat có thể đạt nồng độ lên đến 40% với phương trình điều chế diễn ra theo 2 giai đoạn:
Giai đoạn 1: NaCl rắn + H2SO4 đặc → NaHSO4 + HCl (150 – 250 ºC)
Giai đoạn 2: 2NaCl rắn + H2SO4 đặc → Na2SO4 + 2HCl (500 – 600 ºC)
Sản phẩm được tạo thành có độ tinh khiết cao nhưng không được dùng để sản xuất HCl thương mại vì giá axit sulfuric đắt hơn axit clohydric.